泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2015-08-16 转至微博:
|
医药网8月15日讯 随着我国药品监测网络覆盖面的逐年扩大,及发现和搜集药品不良反应信息能力的增强,近5年,我国ADR报告总数持续上升,2010-2014年我国药品不良反应监测中心累计收到的报告数量约达540万份。而从具体的药品来看,尽管抗感染类、中药注射剂等类别与剂型都是这些年来发生不良反应的“重灾区”,但数据也反映出,这些类别的不良反应正得到重视,整体的用药安全状况也趋向改善状态。
整体:监测覆盖面逐年扩大
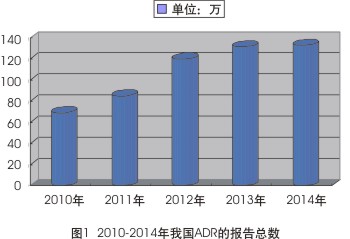
从2010-2014年全国药品不良反应监测网络中心收到的数据报告来看,我国ADR报告份数保持持续、稳定的增长趋势。2014年,我国收到的药品不良反应/事件报告共有132.8万份,较2013年增长了0.8%;2013年,我国ADR报告总数达131.7万份,较2012年增长了9%;2012年的报告总数为120余万份,较2011年增长40.71%;2011年报告总数超85万份,较2010年增长23.08%;2010年报告总数逾69万份,较2009年增长8.4%(见图1)。
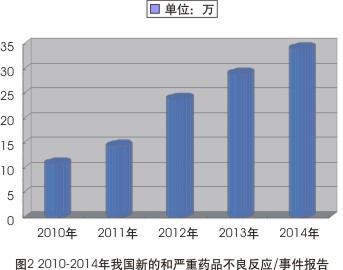
 同时,历年来,新的和严重药品不良反应/事件报告一直是药品不良反应监测的重点,新的和严重报告比例,尤其是严重报告比例是衡量总体报告质量和可利用性的重要指标之一。数据显示,2014年全国药品不良反应监测网络收到新的和严重药品不良反应/事件报告达34.1万份,与2013年的29.1万份相比增长了17.0%;较之2010年的10.9万份,增幅达212%(见图2)。
 总数的上升,得益于我国在药品不良反应监测能力上的提升。据了解,2010年,我国药品不良反应监测网络在线基层用户仅有4万余个;到2014年,全国已有24万余个医疗机构、药品生产经营企业注册为药品不良反应监测网络用户,并通过该网络报送药品不良反应报告。
而这24万余个“用户”所覆盖的范围,也远超国际指标。按照世界卫生组织的推荐,每百万人口的平均报告数量应达到200-400份;而我国此前出台的《药品安全“十二五”规划》提出的目标也是,每百万人口平均报告数量应达到400份——2013年,此数据就达到了983份。而2014年,全国每百万人口平均报告数量达到991份,与2013年相比增加了0.8个百分点,超出十二五既定目标约2.4倍;同时,2014年全国药品不良反应/事件县级报告比例为94.4%,与2013年相比增长了0.6个百分点。
更深入来讲,在我国总体用药规模呈现不断增长的态势下,无论是报告数量的上扬、报告质量的提高,还是药品安全监测覆盖面的扩大与监管网络的发达,都在显示着我国发现和收集药品不良反应信息的能力正进一步增强。
实际上,自2011年7月开始实施新的《药品不良反应报告和监测管理办法》后,新的国家药品不良反应监测系统于2012年随即全面投入使用,由此监测系统的预警、统计和分析功能得以大大加强。
首先,这有赖于国家药监部门数据评价分析能力的提高。以2014年全国药品不良反应监测工作为例,国家药监部门通过日监测、周汇总、季度分析等方法加强对国家药品不良反应监测数据库数据的评价分析,深入挖掘药品风险信号,对阿德福韦酯、胞磷胆碱钠、苯溴马隆等近50个(类)品种进行了安全性评价,并采取了相应的风险管理和沟通措施。
其次,近年来我国药品安全监测预警能力也同样得到重视。2013年的ADR报告指出,国家药品不良反应监测系统功能已实现了实时数据分析和药品风险预警管理,建立了国家和省两级信息共享、高效联动的不良反应/事件预警机制;2014年,药品聚集性事件预警平台得以进一步完善,药监部门建立预警信息全国共享、事发地和生产企业所在地食品药品监管部门协同调查处置联动工作机制,保证药品质量风险的早发现、早评价、早控制。
据了解,2014年全年共有137条预警信息得到重点分析评价,在数量上相较于2013年的61条上涨了一倍多。同时,2014年还及时发现并处置了湖北同济奔达鄂北制药有限公司核黄素磷酸钠注射液、安徽联谊药业股份有限公司胞磷胆碱钠注射液、吉林省集安益盛药业有限公司生脉注射液等多起因药品质量问题引发的不良事件,有效保障公众用药安全。
品类:抗感染类占比下降
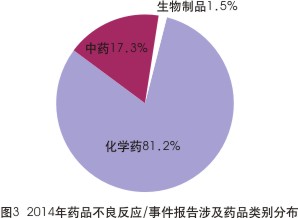
具体到药品品类上来,在2010-2014年的ADR报告中,化学药类不良反应的报告数均占“大头”,基本维持在80%以上。以最新的2014年数据为例,化学药在ADR报告总数中占了81.2%,而中药与生物制品分别占17.3%及1.5%(见图3)。
 其中不得不提到的是,一直以来“霸占”着ADR报告榜首的抗感染药。2014年,全国药品不良反应监测网络共收到抗感染药物的不良反应/事件报告50.6万例,占报告总数的38.2%,其中严重报告2.4万例,占4.8%。
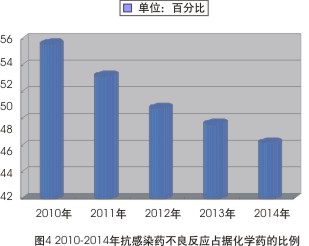
但分析2010-2014年的数据则可发现,抗感染药在整份ADR报告中所占的比例已连续5年出现小幅下降趋势——2010年该类药品不良反应占化学药53.6%,到2014年此数据已经下降至46.2%(见图4)。
 同时,近年来,ADR报告中涉及的抗感染药构成情况也趋于稳定。2014年的ADR报告就涉及了9大类、328个品种,其中抗生素病例报告占66.7%,其排名前5位的是头孢菌素类(32.3%)、大环内酯类(10.7%)、青霉素类(9.7%)、β-内酰胺酶抑制药(5.6%)林可霉素类(3.8%);合成抗菌药病例报告占24.5%,其中主要是喹诺酮类(18.0%)和硝基咪唑类(5.6%)。此药品构成比与2013年的ADR报告并无明显差异。
对此,业界普遍认为,抗感染药不良反应报告总数持续下降,主要是由于我国对该类药物的风险控制取得了一定的成效。早在2012年,卫生部门就已发布《抗菌药物临床应用管理办法》,以加强抗菌药物的合理使用,限制了抗菌药物的使用比例;同时,近年连续开展的“抗菌药物专项整治活动”,也使得各级医疗机构、医务人员愈发重视抗感染药的合理使用,各相关部门也不断加强该类药物不良反应的监测与救治工作,降低其使用风险。
关键词:
|