泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2016-06-16 转至微博:
|
医药网6月15日讯 目前,各省陆续出台仿一致性评价的实施意见,并开展仿制药质量一致性评价工作,“一致性评价”这个词在业内谈了这么多年,终于开始落地了。
根据国务院办公厅3月5日出台的《关于开展仿制药质量和疗效一致性评价的意见》,其中提到,“国内药品生产企业已在欧盟、美国和日本获准上市的仿制药,可以国外注册申报的相关资料为基础,按照化学药品新注册分类申报药品上市,批准上市后视同通过一致性评价;在中国境内用同一生产线生产上市并在欧盟、美国和日本获准上市的药品,视同通过一致性评价”。
而5月26日,国家食药监总局对仿制药一致性评价工作再度发力,发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告,并列出2018年底前须完成仿制药一致性评价品种目录,也就是国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学仿制药口服固体制剂。该目录包含289个药品通用名,细化到剂型和规格。
根据国家食药监总局的要求,对通过质量一致性评价的,各省级药品监督管理部门既要按照核准的处方和工艺,加强生产现场检查;还要按照质量及溶出曲线等质量一致性评价数据,加强监督抽验。对不按照核准的工艺和处方组织生产的、所生产的药品不符合质量标准或质量一致性要求的,依法做出处理。在国家食药监总局规定时间内未通过质量一致性评价的,应当暂停生产;药品批准文号有效期届满时仍未通过质量一致性评价的,不予再注册,注销批准文号。
也就是说,目录中那289个品种必须在2018年底之前完成一致性评价,否则将面临注销药品批准文号的处罚。
有业内人士表示,如今对此的技术要求更高了,一致性评价刚开始,300万已是人情价,再加上前期基础研究的成本,一个产品下来没有800万左右是肯定下不来。完成一个品种一致性评价的成本如此之高,对于不少药企来说,尤其是品种多的药企来说,成本难以负担。
不过,有一点别忘啦,上文提到的,在欧盟、美国和日本获准上市的仿制药,和在中国境内用同一生产线生产上市并在欧盟、美国和日本获准上市的药品,视同通过一致性评价。这意味着,这些豁免一致性评价的药品,成为目前最大的受益者。
长远来看,通过一致性评价的品种,相比于一大波竞争对手,将在药品双信封评审中获得较高质量层次划分及技术标赋分,并且在优先使用,在医保报销环节也将获得优待。
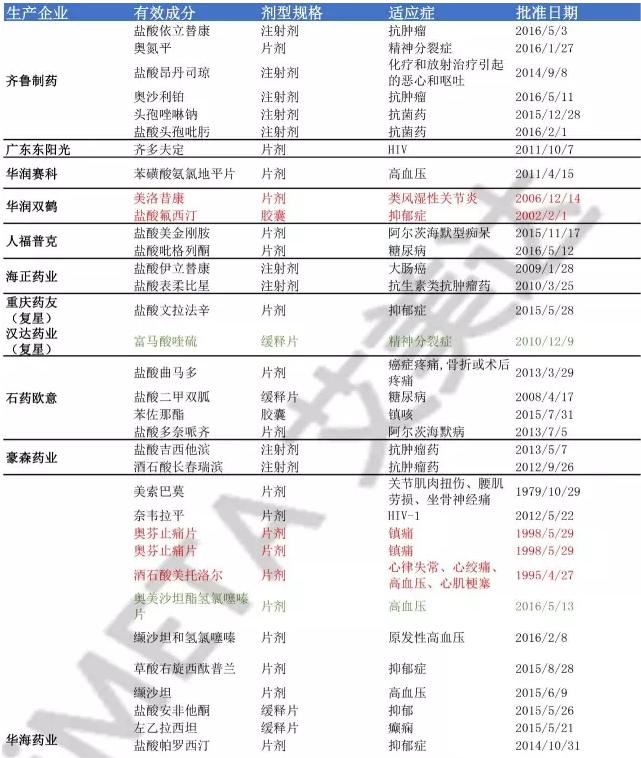
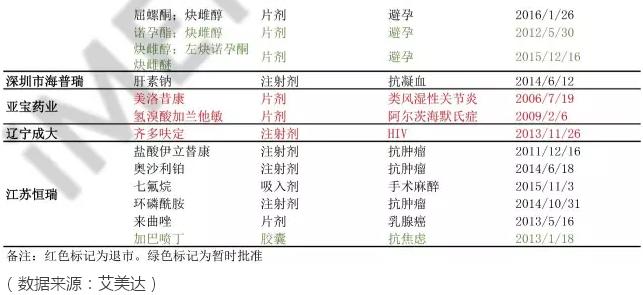
以下是国内在美国上市的仿制药品种和厂家情况,数据统计来源于艾美达。
附:国内企业在美国上市的仿制药品种
关键词:
|