泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2017-02-27 转至微博:
|
医药网2月22日讯 2016年6月,随着国务院办公厅印发《药品上市许可持有人制度试点方案》,上市许可人正式在我国北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川等10省(市)开展试点工作。
除了河北省之外,基本所有试点省市的药监局都已经发布各自的实施方案。
从信息公开的角度来看,政策信息归整方面,目前国家CFDA已在专题专栏下开设“药品上市许可持有人制度试点”专项,在省市药监局设“药品上市许可持有人制度试点”专项栏目的省份只有上海,上海也是唯一一个公布已申请参加药品上市许可持有人制度改革试点品种名单的试点省市。
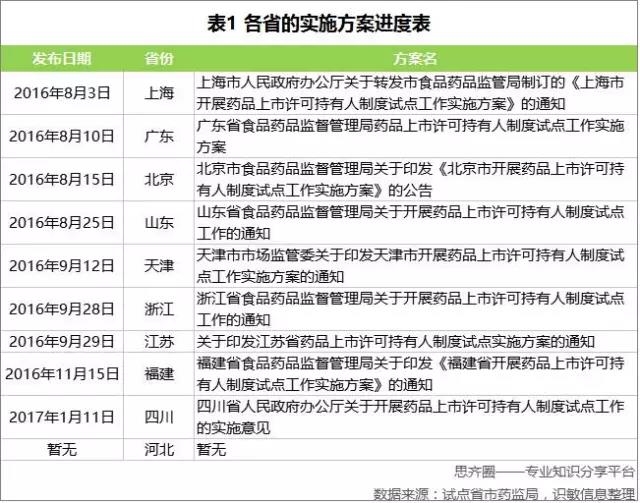 2017年1月,CFDA发布了截至2016年12月25日各试点省份药品上市许可持有人试点品种申报情况的统计数据。
按整体受理号数据统计,广东第一,江苏第二,紧接着是上海和山东。临床试验申请占了整体申请的59%。从临床试验申请来计算,广东、江苏和山东位列前三;若以上市申请统计,则上海、江苏和浙江并列第一;补充申请方面,上海排第一,山东排第二,福建第三。
虽然CFDA了公布了药品上市许可持有人试点品种申报情况,但是具体试点品种信息和对应企业目前CFDA并没有公开信息。
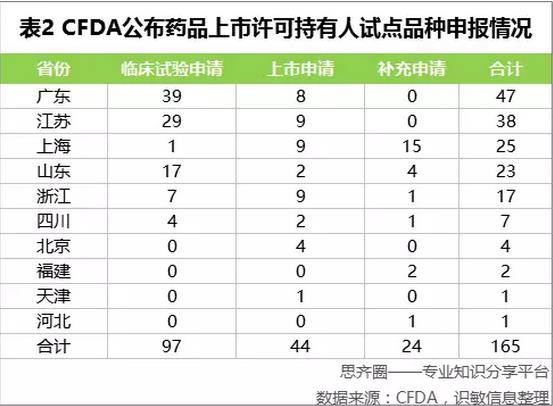 上海是唯一一个公布已申请参加药品上市许可持有人制度改革试点品种名单的试点省市。
广东、江苏则有报道进度汇总,但没有品种详细数据。山东、浙江、四川、北京、福建、天津和河北都没有品种详细数据,同时也没有进度汇总报道。
广东:暂时只有1类新药申报试点品种
从广东药监局发布的《广东扎实推进药品上市许可持有人制度试点工作》信息可知,在广东省受理的1类新药中,有47个受理号同时提出了药品上市许可持有人的申请,广东省局已完成上述品种的受理及现场核查工作上报国家总局。
目前广东所公布的新药申报只有1类新药,旧注册分类申报的化学药品第2—4类、第5类(仅限靶向制剂、缓释制剂、控释制剂),中药及天然药物第2—6类,治疗用生物制品第7类和生物类似药;以及化学药品注册分类改革实施后,按照新的化学药品注册分类(以下简称新注册分类)申报的化学药品第2类的申报暂时空白。
广东省内大型医药集团的兼并重组、整体搬迁等试点工作也已进入操作层面的落实阶段,因此暂无补充申请的数据。此外,按与原研药品质量和疗效一致的新标准批准上市的仿制药的上市许可人申报也仍是空白。
上海:暂时只公布了12个品种明细
在2016年10月25日,上海市食品药品监督管理局《关于上海市已申请参加药品上市许可持有人制度改革试点品种名单的公告(2016年10月25日)》中公布了12个品种,由于1个品种通常含有原料药1个受理号,剂型另外一个受理号,12个品种对应的受理号数接近25个。从公布的结果来看,50%的申请是来自1类新药,50%来自化学药仿制药,暂无中药的申请。
 山东:第一个药品上市许可持有人制度试点品种落地
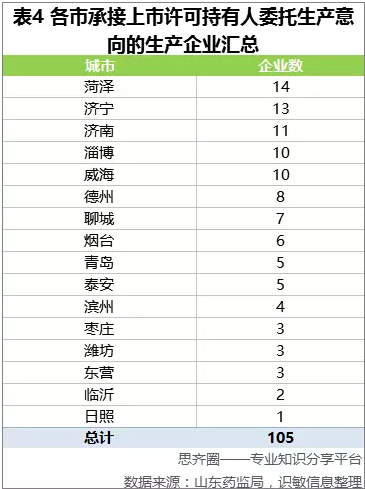
2016年9月,山东为加快推进上市许可人试点工作,争取吸引更多新品种、新技术落户山东省,山东省局建设试点项目“供需”信息平台,推动持有人与生产企业的交流合作,并公布了山东省生产企业承接上市许可持有人委托生产意向能力汇总表。山东省共有105家药品生产企业有意愿接受委托生产,剂型涵盖了口服、外用、注射剂、原料药、生物制品等各大类别。
 12月23日,山东省齐鲁制药研发的新药吉非替尼经CFDA批准获得持有人文号,成为我国首个药品上市许可持有人制度试点品种。
四川:确定5个药品上市许可持有人制度试点区
四川省是所有试点省市中激励产品落地政策最积极的省份。2016年6月,四川省发布《重点联系的十大研发机构实施方案》,重点扶持以为主导的医药产业技术创新体系且支持由企业牵头组建产学研医协同创新平台,生物制药和新型高端化学制药等新兴产业,四川中药珍稀濒危品种和道地良种保护、繁育体系建设及产业化开发等五大重点联系的领域。
2016年8月,四川省食药监局已向成都高新区、成都温江区、泸州医药产业园、眉山经济开发区、岳池医药产业园共5个四川省药品上市许可持有人制度试点工作示范区授牌。
2017年1月11日,四川省《关于开展药品上市许可持有人制度试点工作的实施意见》中对获得全省前10位持有人的申请人,省财政一次性给予适当奖励;各市(州)人民政府可根据实际情况予以激励。但是该方案没有明确这前10位是指获得生产批文还是临床批件就可以获得奖励。
虽然四川现在申报的数量并不在10个试点省份中排名前列,预计重奖之下必有动力,四川省的上市许可持有人的申报将会大幅度增加。
北京:上市许可持有人品种注册优先审查
2016年11月北京市食品药品监督管理局关于印发《北京市优先审查办法》的公告中提到,申请药品上市许可持有人的品种申请人可向市食品药品监管局申请优先办理,完成Ⅱ期临床试验并拟在北京市申请上市许可且是申请药品上市许可持有人的品种可向市食品药品监管局申请项目制管理,进入优先办理程序。
其它暂无品种详细数据也没进度汇总的省份
江苏暂无品种详细数据。在2016年12月新华网的《江苏推进药品审评审批改革》中提到,江苏已有17家单位按试点要求提交19个品种34项注册申请。而在11月的《全省药品上市许可持有人制度试点工作研讨会在宁召开》一文中,该数据为4家单位的4个品种按试点要求提交了8项注册申请。
福建将率先在厦门生物医药港,福州、三明医药产业集中区以及柘荣海西药城开展持有人试点工作探索
结论:
目前对于上市许可持有人试点品种申报的情况还未公开透明化,各省的信息非常碎片化。目前已公布的申报以临床试验申请为主,真正上市的申报还是非常有限。从激励看来,四川激励较为到位。信息公布而言,上海市相对公开及数据齐全。
关键词:
|