泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2018-02-01 转至微博:
|
医药网1月31日讯 19药品,数千批准文号,今年或不用过一致性评价!
▍19药品,被认定为国内特有品种
1月30日,国家食药监总局审评中心发布《关于进一步做好289基药目录中国内特有品种一致性评价工作有关事宜的通知》(下称通知)。
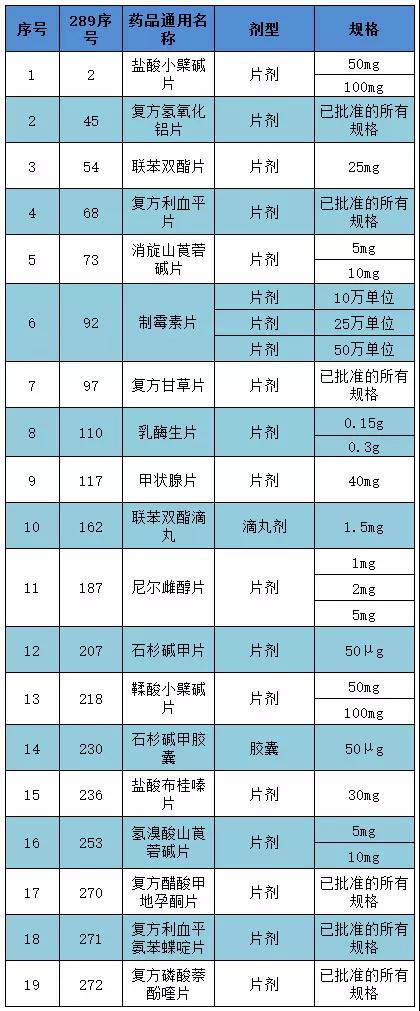
 《通知》显示,在总局《关于仿制药质量和疗效一致性评价工作有关事项的公告》的要求下,药评中心梳理了289目录中的国内特有品种,初步形成了特有品种名单(见附件)。
名单中包括19个药品,所有规格共涉及1590个批准文号。在限定规格下,或有数千药品在特定药品范畴,可能涉及数百药企。
▍特有品种,要重新开展临床试验
2017年4月,在总局发布的《关于仿制药质量和疗效一致性评价工作有关事项的公告》中针对“国内特有品种”提出:
由选择可重新开展临床试验证明其安全有效性,并参照《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》提交申请,后续审核通过后视同通过一致性评价。
企业未选择重新开展临床试验的,总局对外公布其缺乏有效性数据,不建议使用。
▍国办:可宽限到2021年
不过,在2016年3月国办发布的《关于开展仿制药质量和疗效一致性评价的意见》中表示,在2018年底前需要完成一致性评价的药品中,需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价。
是不是看着有点绕?没办法,要把这事说清楚,必须引用大文件。其实用大白话说即:药评中心选出了19个特有品种,根据总局要求,这些药品必须重做临床试验,否则不用。
但此前国办说过,这一类药品的一致性评价,可以宽限到2021年。
▍药企做不做?
看下这19个药品,多为大普药和复方制剂。不是没有参比制剂,就是利润微薄的对投资过一致性评价,产生犹豫。
根据市场反馈,如“盐酸小檗碱片”的厂家,有的就准备放弃。在此次被列入到19个特有品种中,好事是可以宽限到2021年,免不了的还是要临床有效性试验。
只是时间上有了缓冲,到哪一样还需要投资,不知道这些大普药的厂家,会不会做。
附:289基药目录中国内特有品种名单
关键词:
|