泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2018-02-01 转至微博:
|
医药网1月31日讯 1月30日,CDE官方网站发布《关于进一步做好289基药目录中国特有品种一致性评价工作有关事宜的通知》(简称《通知》),经仿制药质量与疗效一致性评价办公室梳理,初步形成19个“国内特有品种名单”。
289基药目录中国内特有品种名单
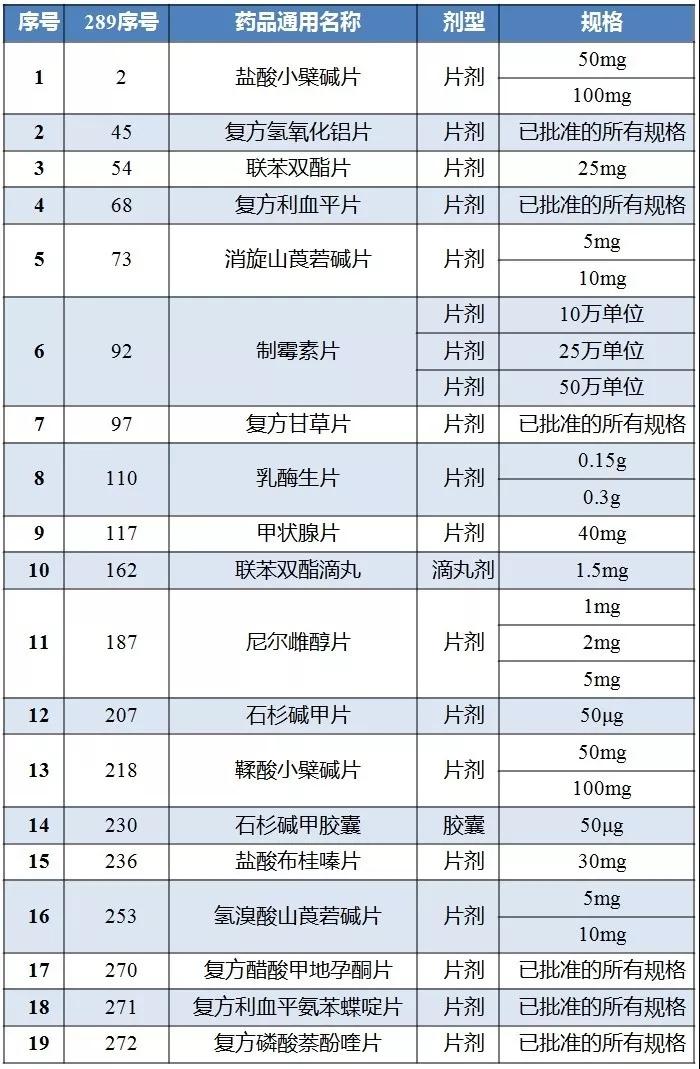 按照《通知》要求,企业应落实评价国内特有品种的主体责任,加快做好评价工作,根据品种具体情况及相关要求进行评估,提出科学合理的评价方案,并及时与仿制药质量与疗效一致性评价办公室沟通。
《通知》进一步明确,仿制药质量与疗效一致性评价办公室将加大对企业国内特有品种评价工作的支持与服务的力度,根据品种研究情况组织专家咨询会,及时解决评价方案中技术不确定的问题,与企业共同加快推进国内特有品种的一致性评价工作。
据记者了解,上述19个国内特有品种大多为复方制剂或没有参比制剂的情况,且产品多数为普种,利润空间微薄,上“大临床”无论时间还是金钱,成本都很难吃得消,按时通过仿制药一致性评价的压力极大。
去年4月,CFDA官网发布《仿制药质量和疗效一致性评价品种分类指导意见》,将一致性评价品种分为6大类,并对不同类别的情况做了具体要求。
其中,针对“国内特有品种”提出:由选择可重新开展临床试验证明其安全有效性,并参照《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》提交申请,后续审核通过后视同通过一致性评价;企业未选择重新开展临床试验的,国家食品药品监督管理总局对外公布其缺乏有效性数据,不建议使用。
彼时,业内对此也有诸多讨论:
“这意味着该类别品种必须重新开展临床试验,2018年年底前很难做完。”
“相较于BE,开展这类大临床试验难度大、成本高、风险大,估计没多少企业愿意冒险。”
“这些品种很多现在临床已经很少使用,销量太少,如果被认定为‘特有品种’,或许意味着产品将退出市场。”
……
不过,根据2016年3月《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),“明确评价对象和时限”条文中提出化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价:国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。
对于这19个“国内特有品种”是否可以归为“开展临床有效性试验和存在特殊情形”的品种而被宽限到2021年,或许这次CDE的举措能够给这些品种留出一线生机。
关键词:
|