泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2018-02-07 转至微博:
|
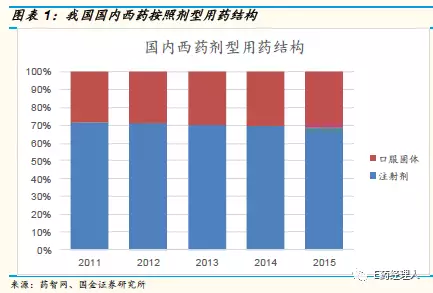
医药网2月6日讯 继口服固体制剂一致性评价之后,对业界影响规模更大的化药注射剂一致性评价被CFDA正式提上工作日程。2016年我国注射剂用药规模达7577亿元,同比增长8.1%,其中化药注射剂占72%的市场份额。
2017年12月22日,CDE发布《已上市化学仿制药(注射剂)一致性评价技术要求》(征求意见稿)(以下简称“意见稿”),对化药注射剂进行一致性评价的参比制剂选择、处方工艺要求、原辅包以及特殊注射剂的一致性评价技术要求进行了具体的规定。这意味着,继口服固体制剂一致性评价之后,对业界影响更大的化药注射剂一致性评价被正式提上工作日程。
更大规模的一致性评价来了
化药注射剂一致性评价,无疑对行业的影响更大。
我国注射剂产业发展迅速,在终端市场份额占比超过50%,具体到西药领域,临床使用超过70%是注射剂型,相对口服固体制剂覆盖范围更广,相关企业也更多。中康CMH监测数据显示,2016年我国注射剂用药规模达7577亿元,同比增长8.1%,其中化药注射剂占72%的市场份额。
 此次意见稿中并未明确需评价品种的具体范围。根据意见稿内容,一般注射剂要从处方、生产工艺等角度进行研究和验证,同时在原料药、辅料、包装等质量控制方面遵循相应要求,无需做BE试验,更多是对杂质、热源反应、安全性方面的再评价。而对于脂质体、静脉乳等特殊注射剂而言,其需要参照FDA、EMA发布的特殊注射剂相关技术要求,并且需要进行BE试验。
2007年以前,业界从商业角度出发,为了改剂型而改剂型的现象非常普遍,产生了很多独家剂型、独家规格,此次意见稿对改剂型、改规格、改盐基注射剂规定,一致性评价应充分论证“三改”的科学性、合理性和必要性,且改后的注射剂应具有明显的临床优势。这表示,将有一部分品种无法通过一致性评价。
且两办《关于深化审评审批制度改革鼓励药品创新的意见》称严格药品注射剂审评审批,“大容量注射剂、小容量注射剂、注射用无菌粉针之间互改剂型的申请,无明显临床优势的不予批准。”从这个角度来讲,注射剂市场也将迎来一轮整合期。无法自证产品安全和有效性的产品,以及没有技术和资金实力做一致性评价的将面临退市结局。
虽然意见稿还未明确一致性评价和时间轴,但2017年10月8日两办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》表示,“力争5~10年基本完成注射剂再评价工作”。
超过52家企业已上马,新赛跑开始
米内网数据库显示,截至2017年12月26日,CFDA批准上市的化学仿制药注射剂有31289个,共涉及820个品种,748家企业。
化药注射剂批文数TOP5企业为华润双鹤、辰欣药业、瑞阳制药、西南药业、湖南科伦制药。但根据新康界数据统计,国产注射剂市场份额TOP5企业为华润、齐鲁制药、科伦药业、复星医药、上海医药集团。
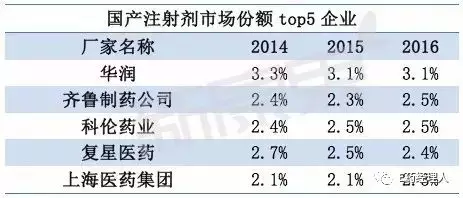 其中,华润在国内注射剂市场上占据份额最大,其注射剂品种多达上百个,销售额较大的包括头孢唑林、氯化钠、参附注射液等;其次是齐鲁制药,前三品种为单唾液酸四己糖神经节苷脂钠、重组人粒细胞刺激因子、多西他赛;科伦药业是氯化钠、葡萄糖品种份额最大的生产厂家。
国产注射剂品种销售额前三为氯化钠、奥美拉唑、单唾液酸四己糖神经节苷脂钠。氯化钠是我国注射剂市场用药最大的品种,厂家有上百个,份额前三的生产厂家分别为科伦药业、华润、石家庄四药;奥美拉唑的领先厂家为江苏奥赛康、阿斯利康制药、武汉普生制药、山东罗欣等;单唾液酸四己糖神经节苷脂钠的主要厂家有齐鲁制药、哈尔滨医大、四环医药等。
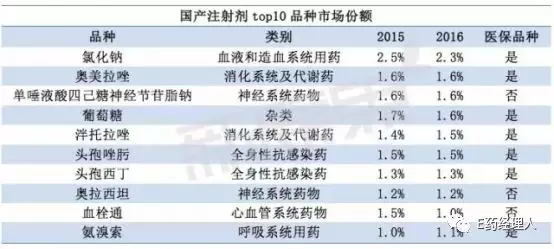 目前,提出注射剂参比制剂备案的企业超过52家,拟评价的注射剂品种达66个。备案品种的治疗类别以抗感染药为主,其次是神经系统用药和消化系统用药,三者合计占51.5%。
参照口服固体制剂一致性评价经验,得到国外药检机构认证获批上市的品种或许会能豁免注射剂一致性评价,将最快受益于行业格局的重塑。如恒瑞医药、普利制药、齐鲁制药、海正药业等均有品种在国外上市。
国内注射剂龙头企业,或本身拥有雄厚资金实力的高质量注射剂研发生产企业,如科伦药业、复星医药、丽珠集团等也将强者恒强。
恒瑞医药:多个注射剂品种在美国上市并盈利
恒瑞医药的传统优势集中在抗肿瘤和麻醉用药产品线,且以注射剂为主。目前,其已经有多西他赛、伊立替康、顺阿曲库铵、右美托咪定、环磷酰胺、奥沙利铂等多个产品在美国上市并盈利。2016年,恒瑞出口业务营业收入达到4.3亿元人民币,其中重点产品为环磷酰胺和奥沙利铂,二者均为注射剂品种。
在国际市场上,注射剂相比口服制剂供应稍显不足,且其生产对无菌的要求更加严格,远高于口服制剂,生产线的建设和维护需要投入更多成本,进入门槛较高。这些客观原因奠定了高端注射剂出口企业在国际上的特殊竞争优势。恒瑞即属于此类企业。
国内市场,多西他赛注射液、注射用奥沙利铂、注射用盐酸伊立替康等品种在2016年终端采购金额均过亿。其中多西他赛、奥沙利铂市场空间过亿,还存在巨大的替代空间,目前恒瑞的终端采购金额稳定,但受益于注射剂一致性评价,进一步增长的机会到来。
卡培他滨的国内市场格局是罗氏的进口品种希罗达和3家国产品种,希罗达2016年的市场份额为67%,进口取代正逐步进行。
浙江医药:领先全球的技术平台
浙江医药在FDA已经递交达托霉素和万古霉素两个品种的505(b)(2)的申请,有望在2018年上市,其“无菌喷雾干燥”技术平台全球领先,在该技术平台下产品均有望以505(b)(2)方式切入美国市场。且已经建立起系统的研发、注册和符合FDA Cgmp认证的生产体系。
505(b)(2)申请途径可获得较长市场独占期,在美国市场利润丰厚的同时也将反哺国内,受益于注射剂一致性评价。根据IMS数据,2015年达托霉素美国市场销售额12.6亿美元,万古霉素美国市场约5亿美元。
健友股份:未来的注射剂出口龙头企业
2013年,成都健进首批无菌注射剂出口美国,成为中国第一个注射剂直接销往美国的企业;2016年,成都健进研发中心零缺陷通过美国FDA认证检查,成为中国第一家通过美国FDA认证的无菌制剂研发机构,成功构建注射剂出口研、产一体化产业链。目前,健友股份已经有3条生产线通过FDA认证。
根据健友股份公告,其处于研发/ANDA申请阶段注射剂产品10余个,彭博终端数据显示美国市场容量超过50亿美元,2018年起将陆续有ANDA获批。重磅产品依诺肝素注射剂预计2018年底欧盟获批(市场容量10亿欧元)、2019年初美国获批(市场容量20亿美元)。
普利制药:十年投入
经过十年的投入,普利制药已经建立起完善的研发、注册、生产体系,每年申报5个左右品种,以注射剂为主,拓展多肽和肿瘤领域,2016年9月三个品种纳入优先审评。
其注射用阿奇霉素已经获美国FDA暂时性批准,在国内通过优先审评获批上市,全球市场3.87亿美元,国内市场达到15亿元。注射用更昔洛韦钠已经通过美国ANDA现场检查,国内正在技术审评中,国内市场规模达7.6亿。
已经在国外上市的注射剂品种。数据来自米内数据库,图片来自经济报。
 更严峻的中药注射剂再评价
事实上,相比于对于注射剂一致性评价,让业界感受到一轮大洗牌的,更多是中药注射剂的再评价。
中药注射剂受累于历史原因,技术不过关,质量监管缺乏标准,再加上用药不规范,滥用明显,用量大等,国家新版医保目录对中药注射剂加以限制,各省、各不断流出重点监控目录,以及限制辅助用药、限制门诊输液等原因,中药注射剂行业整体持续承压。
2017年2月27日,国家食药监总局局长毕井泉正式提出,要启动中药注射剂药品安全性、有效性再评价工作。而业界流传关于中药注射剂的再评价工作已于2015年9月安排在CFDA各司局的职责任务范围内。
但中药注射剂再评价目前缺乏可参考的经验,缺乏工作细则以及中药本身的特殊复杂原因,再评价工作展开也非常困难。2009年,我国旧尝试启动中药注射剂再评价工作,之后并没有真正落地。
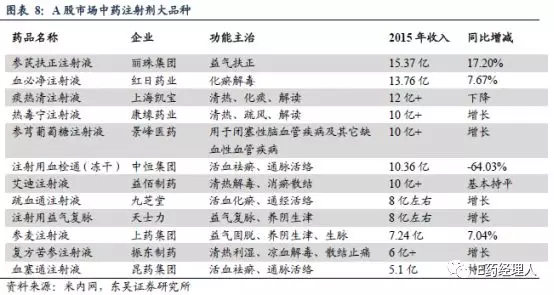
中药注射剂再评价涉及的品种共有112个,涉及厂家最多的TOP10品种分别是柴胡注射液(101家)、香丹注射液(87家)、丹参注射液(58家)、板蓝根注射液(52家)、鹿茸精注射液 (25)、穿心莲注射液 (23家)、灯盏花素注射液(22家)、双黄连滴注液(18家)、双黄连注射液(18家)、红花注射液(16家)。
东吴证券的研究报告显示,中药注射剂现有140多个品种,共1252个批文,产品竞争无序。但同时,中药注射剂市场集中度很高,前10种产品累计比重在45%左右,前20种产品累计比重超过70%。这表示,通过一轮再评价,中药注射剂市场将进一步收缩,大量小散乱的中药注射剂企业退出市场。
而根据近期各种限辅、限门诊输液的趋势分析,即使中药注射剂工作展开困难,市场也将逐步选择产品质量好、销售能力强,以及积极开展临床再评价和基础研究工作的中药注射剂品种,淘汰质量、销售不存在优势的产品。无论从哪个角度分析,中药注射剂的现金奶牛期都已经结束,企业必须寻找新的出路。
2015年A股市场中药注射剂大品种
关键词:
|