泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2018-09-03 转至微博:
|
医药网8月27日讯 据米内网统计,2018年2月至今,国内共有35个新药获批生产,其中有5个为1类新药,分别为恒瑞医药的艾瑞妮、正大天晴的福可维、杰华生物的乐复能、前沿生物的艾可宁以及歌礼药业的戈诺卫,这5款重磅新药,哪个更具爆发力呢?
 江苏恒瑞医药马来酸吡咯替尼片
从上市申请到正式获批仅历时10个月
8月18日,江苏恒瑞医药发布公告称,公司已收到国家监督管理局核发的马来酸吡咯替尼片(商品名艾瑞妮)的《新药证书》和《批件》,公司自主研发的1类抗乳腺癌新药通过优先审评程序获得有条件批准上市。截至目前,公司在该产品的研发项目上已投入研发费用约5.56亿元。
吡咯替尼是一种口服的表皮生长因子受体(EGFR)和人表皮生长因子受体2(HER2)酪氨酸激酶的双重抑制剂,最早于2011年5月27日申报临床,2018年8月13日,其生产申请审批完毕,批准生产,成为我国首个基于II期临床研究成果获得国家药监局有条件批准上市的治疗实体瘤的创新药。据恒瑞公告,该产品从上市申请到正式获批仅历时10个月。
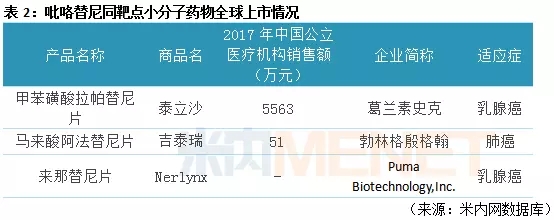 据米内网全球药物研发库数据,目前已上市的吡咯替尼同靶点小分子药物有葛兰素史克的甲苯磺酸拉帕替尼片(商品名泰立沙)、勃林格殷格翰的马来酸阿法替尼片(商品名吉泰瑞)以及Puma Biotechnology,Inc.的来那替尼片(商品名Nerlynx)。
泰立沙由葛兰素史克研发,最早于2007年3月获得美国FDA批准上市,该产品是全球首个上市的EGFR/ERBB2抑制剂,在国内已获批上市,2017年在中国公立医疗机构终端泰立沙的销售额为5563万元,同比去年增长106.07%。
吉泰瑞由勃林格殷格翰研发,最早于2013年7月获得美国FDA批准上市,2017年3月,该产品获得国家药监局批准进入中国,2017年在中国公立医疗机构终端吉泰瑞的销售额为51万元。
Nerlynx由Puma Biotechnology,Inc.研发,于2017年7月获得美国FDA批准上市,用于已完成标准曲妥珠单抗(商品名赫赛汀)辅助治疗,疾病未进展但存在高危因素的乳腺癌患者,是首个经FDA批准的“强化辅助治疗”用药,该产品目前还未在国内上市。
歌礼达诺瑞韦钠片
国内首个本土原研丙肝1类新药
6月13日,歌礼在官网宣布,公司自主研发的国内首个本土原研丙肝1类新药达诺瑞韦钠片(又称丹诺瑞韦钠片,商品名戈诺卫)获国家药品监督管理局批准上市。
达诺瑞韦是歌礼开发的具有自主知识产权的新一代NS3/4A蛋白酶抑制剂,在中国大陆地区完成的III期临床试验结果显示,经过12周治疗,在基因1型非肝硬化患者中治愈率(SVR12)达97%;在基因4型非肝硬化患者中的治愈率达100%。
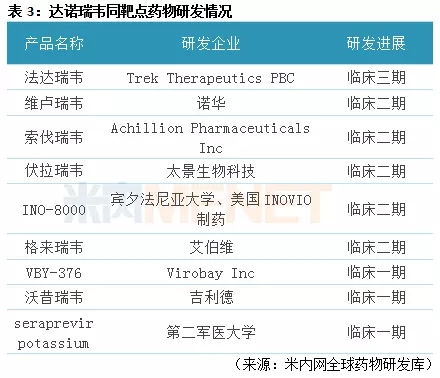 据米内网全球药物研发库数据,目前全球已上市的NS3/4A蛋白酶抑制剂包括强生的西美瑞韦、默沙东的波西普韦、施贵宝的阿那匹韦等,这些产品还未在国内上市。从NS3/4A蛋白酶抑制剂全球研发进程看,Trek Therapeutics PBC的法达瑞韦已处于临床III期阶段,诺华的维卢瑞韦、太景生物科技的伏拉瑞韦等均处于临床II期阶段。
除了已经获批的戈诺卫,歌礼开发的另一款抗丙肝1类新药拉维达韦(新一代全基因型NS5A抑制剂)也已完成II/III期临床研究,目前已提交上市申请。临床研究表明,拉维达韦联合戈诺卫组成的首个中国原研全口服无干扰素方案,在基因1型非肝硬化患者中治愈率(SVR12)达99%,且针对基线发生NS5A耐药突变的患者,100%实现SVR12。
前沿生物注射用艾博卫泰
全球首个长效抗艾滋病新药
6月5日,前沿生物在官网宣布,公司自主研发的国家1类新药注射用艾博卫泰(商品名艾可宁)获得国家药品监督管理局批准上市。艾可宁是全球第一个长效HIV-1融合抑制剂、中国第一个原创抗艾新药,拥有全球知识产权。
艾博卫泰是一种全新的长效HIV-1融合抑制剂,隶属于gp41抑制剂,它适用于与其它抗反转录病毒药物联合使用,治疗已接受过抗病毒药物治疗的HIV-1感染者。新分子作用机制使其对主要流行的HIV-1病毒以及耐药病毒均有效,长效注射给药方式是目前口服药治疗方案的一个重要补充和提升。
临床Ⅲ期试验中期数据显示,每周注射一次艾可宁联合洛匹那韦/利托那韦(二药组合,试验组)治疗“一线配方治疗失败的HIV-1感染者”,其疗效与WHO推荐的二线配方(三药组合,对照组)相当或更优,与含有替诺福韦的对照组相比显示出有统计意义的更优肾脏安全性。
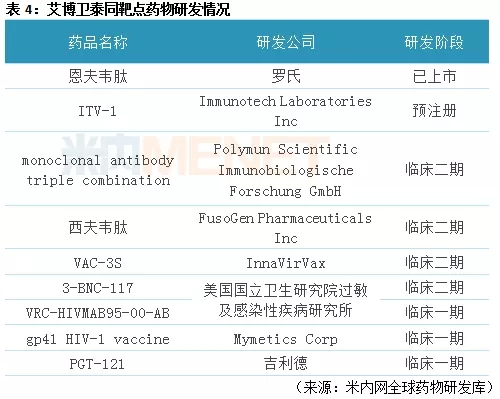 据米内网全球药物研发库,目前全球市场上,同属于gp41抑制剂的抗艾滋病药物,罗氏的恩夫韦肽已经上市,只是目前还未进入中国市场,Immunotech Laboratories Inc的ITV-1已提交上市申请,距离获批上市指日可待。
正大天晴盐酸安罗替尼胶囊
填补非小细胞肺癌三线治疗的空白
5月10日,中国生物制药发布公告称,其附属公司正大天晴药业自主研发的抗肿瘤1类化药盐酸安罗替尼胶囊(商品名福可维)获国家药品监督管理局颁发的《新药证书》和《药品注册批件》,这标志着备受关注的中国肿瘤领域原研创新药获批上市。
安罗替尼是由正大天晴自主研发的1类新药,也是迄今为止投入最多的抗癌药。它是一种新型小分子多靶点酪氨酸激酶抑制剂,能有效作用于VEGFR、PDGFR、FGFR、c-Kit等靶点,具有抗肿瘤血管生成和抑制肿瘤生长的双重作用。
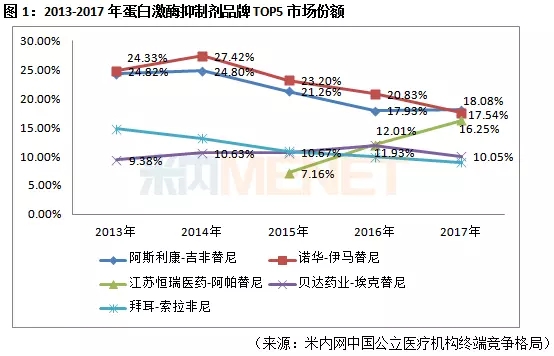 据米内网数据,2017年中国公立医疗机构终端蛋白激酶抑制剂总体市场为86.72亿元,同比去年增长26.92%。在TOP5品牌中,诺华、阿斯利康等国外占据主要市场,近几年来,随着国内产品的不断上市,国外企业的市场份额呈现下降趋势,国内企业奋勇直上,江苏恒瑞的阿帕替尼于2015年获批上市,2017年就跻身前三甲,增速十分迅猛。
临床试验证实,安罗替尼对晚期非小细胞肺癌(NSCLC)有较好的治疗效果,此外临床研究表明,安罗替尼对软组织肉瘤、卵巢癌等多个癌种也有治疗效果。据悉,正大天晴正在积极开展包括美国在内的多中心临床试验研究,对多个癌症病种的临床进展已经进入到Ⅱ/Ⅲ期研究,包含有甲状腺髓样癌、非小细胞肺癌肺癌、软组织肉瘤等。随着国外市场的开拓及即将获批多个不同的适应症,安罗替尼市场前景可期可待。
杰华生物重组细胞因子基因衍生蛋白注射液
全球首个第3类乙肝治疗药物
4月28日,杰华生物在官网宣布,公司已收到国家药监局核发的原创生物新药重组细胞因子基因衍生蛋白注射液(商品名乐复能)的《新药证书》和《药品注册批件》,这意味着杰华生物研发的第一个生物新药经过18年漫长的实验室研发测试、临床前和临床研究、国家药监局的审评审批,终于获得批准上市。
乐复能是杰华生物在人体天然免疫调节蛋白分子结构基础上进行氨基酸序列系统改造,研发创造的新型高效人体免疫功能调节蛋白分子,通过更高效的调节和增强免疫功能,表现出治疗病毒疾病、恶性肿瘤和自身免疫性疾病的效果,属于“免疫治疗”药物。临床揭盲结果显示,经乐复能治疗6个月的乙肝病人,e抗原转阴率(临床治愈率)达49.06%,优于国际上目前使用的其他药品。
国家药典委员会认可乐复能属于国内外均没有出现过的创新生物药(first in class),证明乐复能是乙肝治疗药物中,除口服直接抗病毒药(核苷类)和干扰素(普通和长效)两大类药物以外,30多年来研发成功的第一个全新种类乙肝治疗药物。
干扰素(普通干扰素、长效干扰素)被称为疗效与麻烦同在的“富人药”,较多和价格昂贵是限制其使用的两大瓶颈。因此,口服直接抗病毒药在乙肝治疗领域处于主导地位,据统计,目前国内上市的治疗乙肝的直接抗病毒药有5个,分别为拉米夫定、阿德福韦、恩替卡韦、替比夫定、替诺福韦。
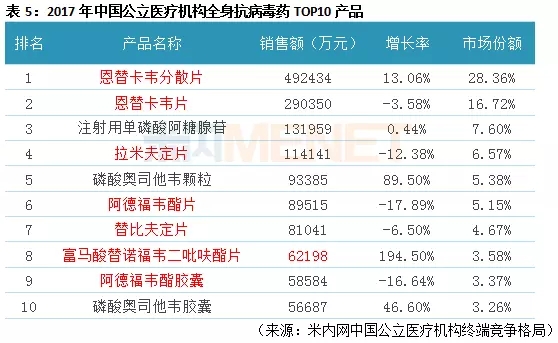 据米内网数据,2017年中国公立医疗机构终端全身抗病毒药物总体市场为173.67亿元,同比去年增长8.42%。在全身抗病毒药物TOP10产品中,有7个产品属于直接抗乙肝病毒药物(表5中红色标志部分),恩替卡韦分散片以28.36%的市场份额位居首位,其在2017年中国医疗机构终端的销售额为49.24亿元,同比去年增长13.06%,恩替卡韦片则以16.72%的市场份额排位第二。从品牌竞争情况看,有7家企业拥有恩替卡韦分散片的生产批文,正大天晴药业所占市场份额最高,而恩替卡韦片市场被原研厂家施贵宝所占。
来源:米内网数据库、公司官网等
关键词:
|