泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2016-04-19 转至微博:
|
医药网4月15日讯 新药销售TOP 15是GEN公司每年必发的“例牌”,2015年上市新药销售TOP15榜单亦如期于3月公布。从榜单来看,吉利德2013年及2014年分别获批的丙肝药Sovaldi、Harvoni的销售业绩可谓传奇;2015年2月获批的辉瑞治疗乳腺癌药物Ibrance,以年销售7.23亿美元的业绩接近撞线重磅药大门。
追踪近三年的新“药王”,故事新奇度令人瞠目。2013年上市的Sovaldi,2014年销售飙升至102.8亿美元,2015年销售直落至52.8亿美元,犹如“过山车”般感觉;2014年上市的Harvoni,销售额由2014年的21.3亿美元直接上窜至2015年的138.6亿美元,其2016年的销售业绩毫无疑问成为万众关注的焦点。2015年的Ibrance,应不会有如此令人心跳的感觉,但今年销售轻松打榜重磅药榜单已是大势所趋。
那么,2016年第一季出现在大家面前的新药,给人心跳的感觉,是万马奔腾还是静水微澜呢?
美国:批准2个NDA和3个BLA
2016年第一季,FDA公布了848条审批信息。其中,一月份258条审批信息,包括NDA(新药申请)193条、BLA(生物制品申请)8条、ANDA(简略新药申请)57条;这其中包含49条批准信息;另外还有17条临时性批准信息,其余为标签变更、补充临床数据等相关信息。二月份共计279条审批信息,包括NDA 215条、BLA 5条、ANDA 59条;这其中包含59条批准信息,9条临时性批准信息,其余为其他相关信息。三月份共计311条审批信息,包括NDA 226条、BLA 12条、ANDA 73条;这其中包含67条批准信息,13条临时性批准信息,其余为其他相关信息。
总体来看,第一季共批准2个新分子实体和3个生物制品。
 2月,FDA一口气批准优时比治疗癫痫药物BRIVIACT的片剂、注射液以及口服溶液3种剂型的多个规格。它是优时比重磅抗癫痫药物开浦兰(左乙拉西坦)专利陆续到期后,推出的一款新型的抗癫痫药。开浦兰是1999年获批的新分子实体,2008年销售达到峰值的12.66亿欧元,在其排他性销售陆续到期(美国到2008年、欧洲2010年)后,销售开始下滑。好在其日本市场排他性销售要到2018年才到期,其2015年的销售依然坚挺在7.37亿欧元的水平。BRIVIACT与开浦兰结构类似,临床研究证实,与安慰剂组相比布瓦西坦每28天部分性发作(POS)频率明显减少。基于其良好的药理学活性、临床疗效及安全性,BRIVIACT有望成为继左乙拉西坦后又一重磅抗癫痫药物。
 3月Defitelio的获批,标志着美国首款治疗严重肝静脉阻塞的药物得以上市。肝静脉阻塞是一种罕见却致命的,通常见于那些接受过高剂量化疗以及血液干细胞移植的血癌患者。接受血液干细胞移植的人群中,有2%会出现这类并发症,其中80%都是致命的。该药在2013年就获得欧盟的批准,时间先于美国一年半。
3月获批的一款吸入性炭疽治疗新药Anthim,是一种单克隆抗体,旨在中和炭疽杆菌产生的毒素。炭疽是一种潜在的生物恐怖威胁,它的获批标志着美国反恐防恐的未雨绸缪。
欧盟:生物仿制药Benepali吸睛
欧盟2016年截至3月31日批准了22个药物。
其中,1月获批的由韩国生物制药开发的依那西普生物仿制药Benepali特别引人注目。它是继去年9月获得韩国监管部门批准之后,首个欧盟批准的依那西普生物仿制药,临床用于中度至重度类风湿性关节炎、银屑病关节炎、非放射性中轴性脊柱关节炎、银屑病成人患者的治疗。
优时比治疗癫痫药物BRIVIACT在欧盟的获批也在第一季度,并早于美国,是1月获得欧盟批准的。
3月欧盟批准了2个孤儿药上市,其中一个是治疗罕见出血性疾病——遗传性凝血因子X缺陷症的药物Coagadex,而它早在2015年10月就获得FDA的批准。另一个是治疗治疗伴随或不伴随猝倒发作嗜睡症的Wakix,早在去年11月CHMP就建议批准Bioprojet制药的本品,3月31日终于获批。
中国::国内申请生产的新药凋零
经过药物注册申请积压以及药物再评价等一系列事件后,国内今年一季度药物批文数量屈指可数。从2月CFDA开始公布月度批准上市情况来看,截至目前,国内第一季度共批准了44个药品上市,其中一月2个、二月15个、三月27个批文。
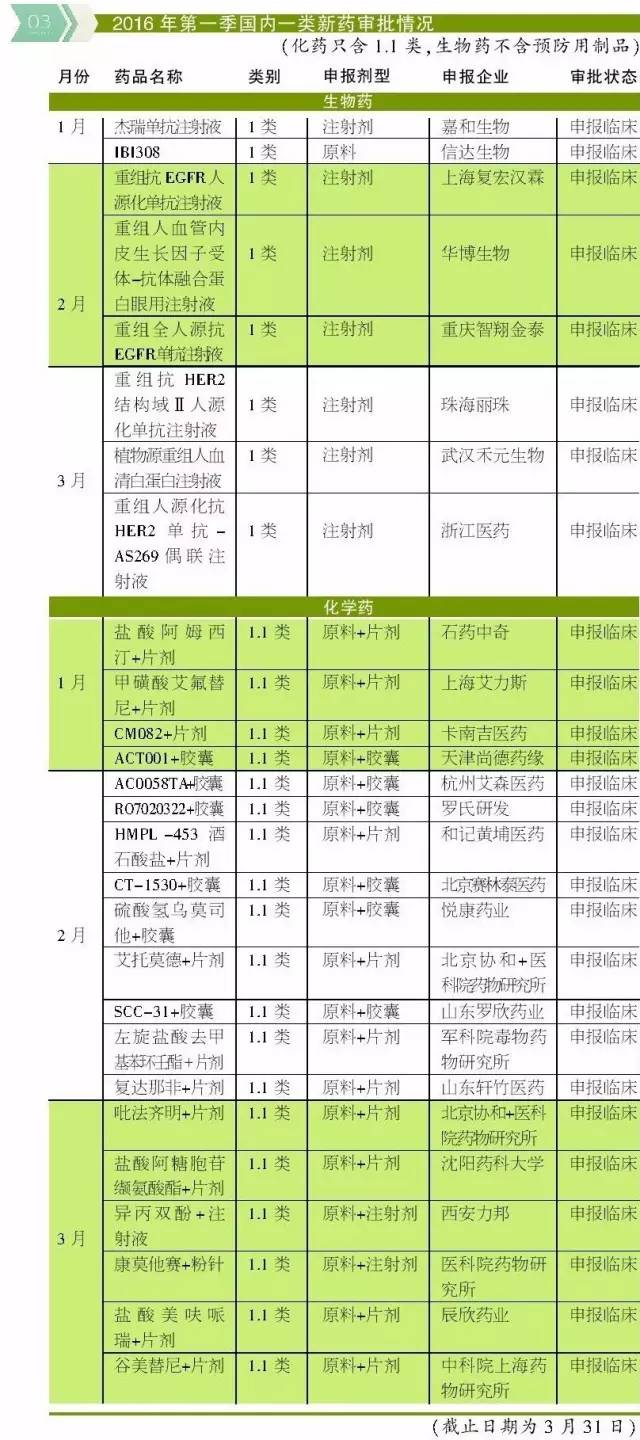 药物注册方面,进口注册的生物抗体类药物等引起了笔者的关注。随着抗体类药物的持续发烧,欲进入中国市场的此类药物日渐“豪华”。2月有申请临床的Pembrolizumab、Nivolumab、Atezolizumab、Anetumab Ravtansine、美泊利单抗;3月有申请临床的Idarucizumab、PDR001、Avelumab、Tremelimumab、Solanezumab。
其中Pembrolizumab和Nivolumab于2014年获FDA批准,美泊利单抗和Idarucizumab于2015年获FDA批准。而Atezolizumab、Avelumab、Tremelimumab等均处于临床试验阶段。Atezolizumab和Avelumab等属于近年来炙手可热的PD-L1免疫疗法,分别获得FDA授予的优先审查资格及突破性疗法认定。
国内新药注册方面,虽然去年屠呦呦获诺贝尔奖引发中药研发热潮,但一季度没有一类中药新药的申报信息。而化药和生物药的1类新药基本都处于申请临床阶段,离上市时间尚远。值得注意的是,处于申请生产状态的药物,不论中药、化药还是生物药基本属于仿制药,只有四川科伦药业的碳酸氢钠林格注射液属于化药3.2类新药。
关键词:
|