泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2016-06-12 转至微博:
|
医药网6月6日讯 6月3日,CFDI(CFDA食品药品审核查验中心)发布了《2015年度药品检查报告》,全面回顾了2015年药品GMP认证检查、注册生产现场检查、GMP跟踪检查、中药材GAP认证检查、进口药品境外生产现场检查、飞行检查及国际观察检查情况。
1、GMP检查是主要检查任务
2015年,总局核查中心组织开展GMP认证检查、注册生产现场检查、GMP跟踪检查、中GAP认证检查、进口药品境外生产现场检查、飞行检查及国际观察检查共计 698家/次。其中,GMP检查(药品GMP认证检查和药品GMP跟踪检查)占据了检查任务的50%以上的份额。
 2、GMP认证检查整改复核检查和发放告诫信的比例上升
根据报告,药品GMP认证检查数量较前两年减少,全年共安排检查224家/次,接收现场检查报告236份,完成审核件221份,其中212家药品生产企业通过药品GMP认证检查,9家药品生产企业未通过药品GMP认证检查,占4.1%。整改复核检查和发放告诫信的企业较前两年比例明显上升,整改复核检查17家占7.7%,发出告诫信的企业68家,占13. 1%。发告诫信最多的省份是江苏、湖南和四川。
从2015年GMP申请认证的剂型包括大容量注射剂、小容量注射剂、冻干粉针剂、粉针剂、疫苗类产品、血液制品等可以看出,在2013年12月31日以后,仍是有生产厂家继续认证血液制品、疫苗、注射剂等无菌药品。(注:2013年12月31日以前此类药品的生产厂家若没有通过2010年版GMP认证将面临停产)
根据报告可知,认证检查的企业中相当一部分是经历搬迁或异地改造后申请认证的,但其在申请认证检查中并没有选择风险高、工艺复杂的品种动态生产,而是选择风险最低、工艺最简单的品种,甚至选择氯化钠注射液、葡萄糖注射液等品种,并不能代表其人员、设施设备与质量体系运行的最差条件,使得在短暂的现场检查中问题的发现和风险的识别带来一定的局限性。另一方面,新转移来的大多数品种在认证检查时没有完成工艺验证,同样使得认证后的风险加大、认证后的日常监管压力加大。总局核査中心为此加大了告诫力度,告诫信的问题大多集中于此。
设备方面发现主要缺陷较少,目前缺陷主要集中在设备维护保养,计量设备的校准等方面,这也说明药品2010年版GMP实施以来,我国药品生产企业设备的更新换代较为彻底,企业也较为重视。
虽然在我国GMP认证检查工作已经在2016年下放至省局,为使认证检查局限性带来的风险降到最低,2016年总局检查中心将进一步加大跟踪检查力度,将以往以剂型为主线的检查模式逐步回归到以品种为主线的检查模式,基于风险、基于企业过往的认证检查情况,以问题和风险信号为导向,有针对性的开展检査。
3、GMP跟踪检查注重风险管理
2015年药品GMP跟踪检查计划271家/次,主要为注射剂、预防类生物制品(疫苗),同时涵盖口服固体制剂、体外诊断试剂、原料药等。此外,2015年选取胸腺肽类产品生产企业作为针对生化药品行业进行跟踪检查。在121家胸腺肽类药品生产企业中,其中99家停产或不具备生产条件,实际共对22家企业实施了药品GMP跟踪检查。
无论是GMP认证检查还是跟踪检查,风险管理原则被多次提及,这可以体现出总局检查中心在吸收美国FDA的经验:美国FDA并不将检查过程中发现的所有问题均作为最终缺陷项,检查员根据发现的问题结合对产品的风险进行判断后形成最终缺陷项,并在召开检查末次会时书面告知企业。
4、江苏省药品注册生产现场检查数量最多
2015年总局检查中心共对114个品种(规格)进行药品注册生产现场检查,包括化学原料药31个、化药制剂56个、中药8个、生物制品15个、血液制品4个,涉及片剂、胶囊剂、颗粒剂、溶液剂、软膏剂、外用冻干制剂、丸剂、原料药、口服溶液剂和注射剂共9个剂型。
在药审中心2015年发出的123个注册生产现场检查任务中,企业提交申请93个,占76%;当年开展现场检查69个,占申请数量76%,企业撤回注册申请及现场检查的10个,占申请数量11%;临床自查品种9个。对4个品种开展有因核查,其中2个釆取飞行检查模式。
各省注册生产现场检查数量可以从侧面体现各省的注册现状,江苏省注册生产现场检查数量最多,共16个;其次是广东省11个;再次是山东省10个。
5、飞行检查中发现中药饮片走票过票
2015年总局检查中心共派出49个检查组对59个企业进行了飞行检查, 其中银杏叶提取物及制剂5个组8家企业,中药饮片14个组19家企业,中药提取物1个组2家企业,中药制剂6个组6家企业,生化药品8个组8家企业,化学原料药8个组9家企业,化学药制剂6个组6家企业,血液制品1个组1家企业。
接受飞行检查的59家企业中,现场检查通过的19家;不通过的39家;1家待处理。对不通过的39家中的37家采取了处理措施,其中22家被收回药品GMP 证书,6家被吊销药品生产许可证,3家立案查处。
值得注意的是中药饮片在飞行检查中发现走票过票问题,为不法分子的经营活动提供便利,部分企业为药贩子或经营企业生产、销售假药提供便利,并且虚开票据,使其合法化,导致大量无法保证质量的中药饮片流入市场。
6、加大进口药品境外生产现场检查
自2011年起,总局检查中心共68个检查组前往20个国家对73个品种进行了检查。前3年检查暴露出境外企业不重视我国药品相关法律、不按照我国要求组织生产、对出口我国和出口其他国家的产品区别对待等问题。自2014年起,总局检查中心检查数量逐年加大,力求检查覆盖更加全面。对产品进口量大、注册量多及药品合规性风险较高的国家和地区进行重点检查。
2015年共34个品种列入了现场检查任务,总局检查中心已完成检查25个品种,3个品种的生产企业明确表示不接受或故意拖延检查,另有6个品种因外事或审评等原因推迟至2016年检查。
值得注意的是德国某公司的某植物药固体制剂变更用药人群未及时申报被点名。原注册申报说明书的适用人群为成人、0-6岁和7-12岁儿童。2007年8月德国当局重新颁发上市销售许可证书时调整用药人群为12岁以上成人(原因:某成分容易导致儿童过敏),但企业于2008年提出再注册申请时仍沿用原用法用量。
7、国外监管机构GMP检查的观察以原料药为主
根据总局国际会作司来函要求,总局检查中心组织药品GMP检查员参加各类国际药品GMP检查观察工作。2015年完成观察74次,包括批准前检查、跟踪检查和飞行检查等不同类型。检查内容方面,尽管不同药品GMP检查机构检查的重点存在一定的差异,但对质量控制与质量保证、物料与产品、 生产管理、确认与验证的关注相对比较高。
2015年国外监管机构GMP检查的观察任务渉及浙江、上海等18个省市,其中浙江、上海、 广东、江苏、河北、山东占全部任务量的17%。浙江22个观察任务占据30%全国最高。
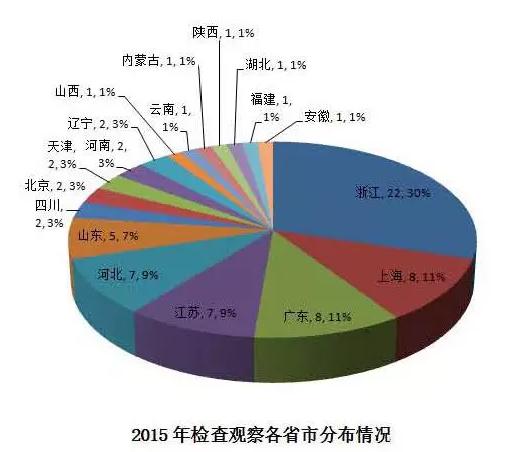 国际药品GMP检查观察中涉及到的药品包括原料药、口服固体制剂、生物制剂、吸入剂、中间体、诊断试剂、膳食补充剂等147个产品。在147个检查的产品中,包括99个原料药的检查,33个口服固体制剂的检查,5个生物制剂的检查。
74次检查观察中,检查范围包括原料药的检查次数共54次,约占全部检查次数的73%,可见我国的出口项目主要还是以原料药为主。检查范围包括口服固体制剂的检查次数10次,约占全部检查次数14%。
检查的包括69家,其中国有企业16家,三资企业25家,私营企业28家。
关键词:
|